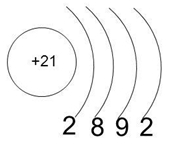
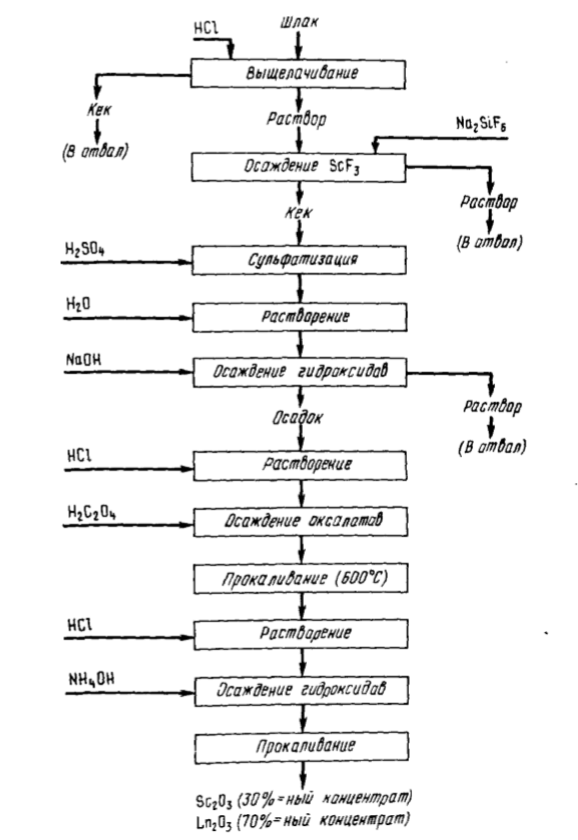
Электронная формула скандия
Скандий — элемент побочной подгруппы третьей группы, четвёртого периода периодической системы химических элементов Д. Менделеева, с атомным номером Обозначается символом Sc лат. Простое вещество скандий CAS-номер: — лёгкий металл серебристого цвета с характерным жёлтым отливом. Элемент был предсказан Д.
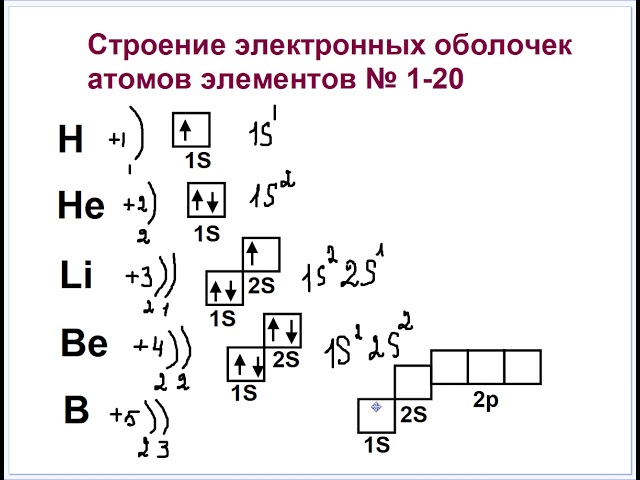

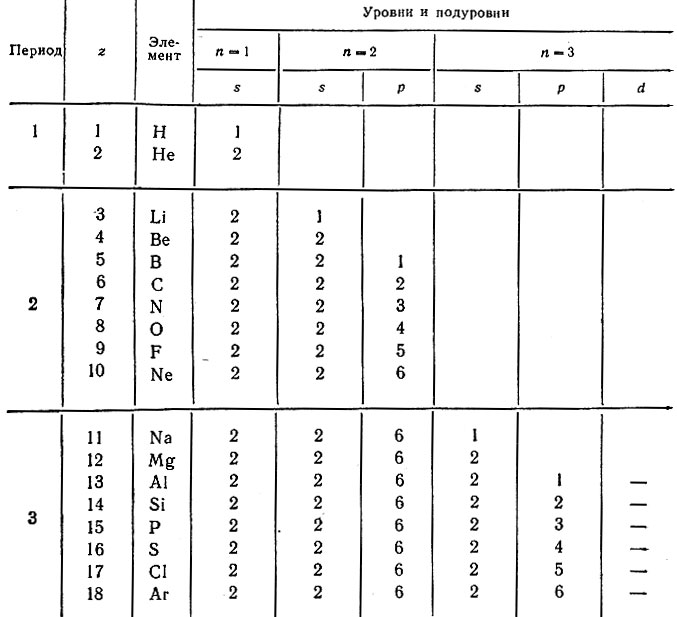
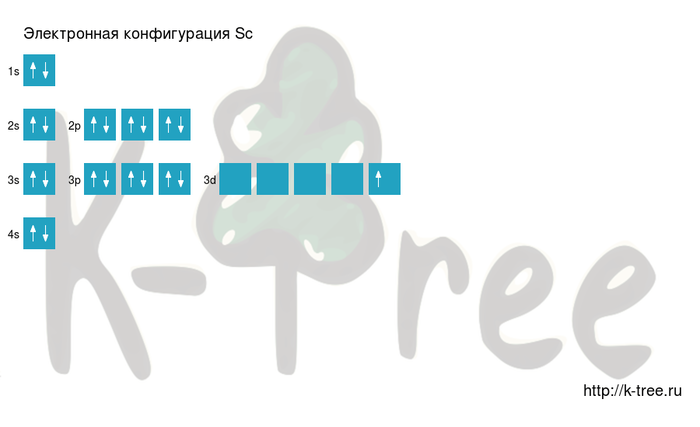
На этой странице показаны электронные конфигурации нейтральных атомов в их основных состояниях. Для каждого атома подоболочки даны сначала в краткой форме, затем со всеми выписанными подоболочками, за которыми следует число электронов на оболочку. Все данные, представленные выше, согласуются с традиционными источниками, кроме случаев, перечисленных ниже. Этот веб-сайт также процитирован в CRC руководстве англ. CRC Handbook как источник секции 1, подсекции электронная конфигурация нейтральных атомов в основном состоянии. Материал из Википедии — свободной энциклопедии.
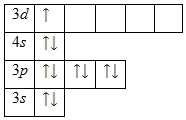


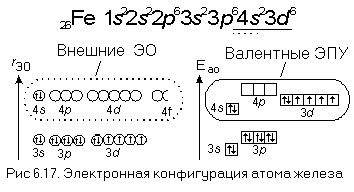

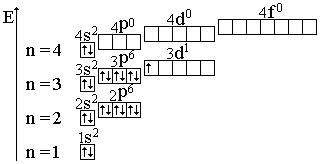
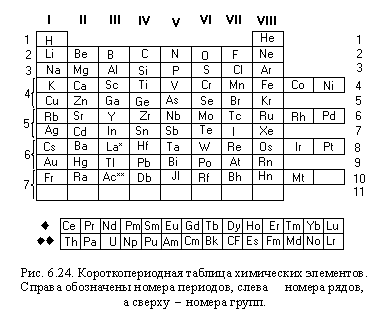
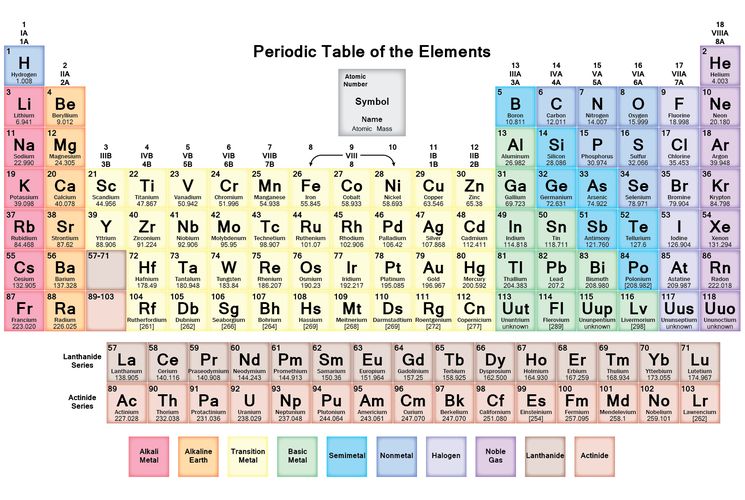
Между положением элемента в периодической системе элементов и распределением электронов в его атоме по энергетическим уровням наблюдается определенная связь. Ёмкость первого энергетического уровня на этом исчерпана, поэтому следующий электрон оказывается на втором энергетическом уровне - в Периодической системе открывается второй период. На втором энергетическом уровне может находиться не больше восьми электронов, поэтому в данном периоде не может быть больше восьми элементов. Далее следует третий период. Тем не менее период завершается. Некоторые особенности появляются при формировании электрон-ных оболочек в атомах элементов шестого периода.